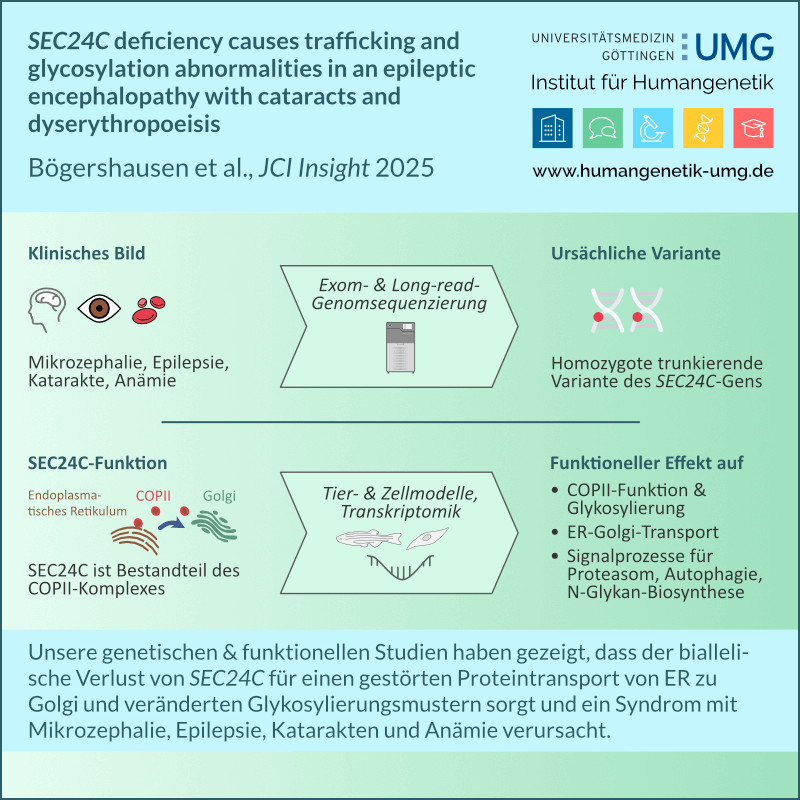
MoReHealth Niedersachsen: MultiOmics-Initiative für Personalisierte Medizin
MoReHealth Niedersachsen ist ein innovatives Forschungsprojekt, das neueste MultiOmics-Forschung – also die gleichzeitige Analyse und Interpretation unterschiedlicher biologischer Ebenen wie DNA, Proteine und Stoffwechselprodukte – in eine breit anwendbare, personalisierte Gesundheitsversorgung überträgt. Das Projekt wird von herausragenden Expert*innen der führenden wissenschaftlichen Einrichtungen des Landes Niedersachsen durchgeführt: der Medizinischen Hochschule Hannover (MHH), der Universitätsmedizin Göttingen (UMG), dem Helmholtz-Zentrum für Infektionsforschung in Hannover und der Technischen Universität Braunschweig. Konkret untersuchen die beteiligten Wissenschaftler*innen, warum ältere Menschen besonders anfällig für Infektionskrankheiten sind und wie dieses Wissen genutzt werden kann, um diese Erkrankungen besser vorherzusagen, zu vermeiden und zu behandeln. Ziel ist es, mit Hilfe moderner Technologien neue Wege für personalisierte Prävention, Diagnostik und Therapie zu eröffnen.
MoReHealth wird für vier Jahre mit insgesamt drei Millionen Euro vom Niedersächsischen Ministerium für Wissenschaft und Kultur und der Volkswagenstiftung gefördert. Starten wird das von Prof. Thomas Illig (Hannover Unified Biobank, MHH) koordinierte Projekt am 01. September 2025. Das Teilprojekt der UMG wird am Institut für Humangenetik durchgeführt und von Prof. Bernd Wollnik und Dr. Julia Schmidt geleitet.
Praxisfall: Infektanfälligkeit im Alter
Mit zunehmendem Alter lässt die Immunabwehr des Menschen nach. Dadurch sind ältere Menschen anfälliger für Infektionserkrankungen wie beispielsweise die Gürtelrose (Herpes Zoster). Die Erkrankung kann milde verlaufen, aber besonders bei Senior*innen kommt es oft zu ernsten Komplikationen des Nervensystems, auch mit dauerhaften Schmerzen und neurologischen Schädigungen. Um die Versorgung der Patient*innen zu verbessern, ist es wichtig, die genetischen und biologischen Gründe für diese Unterschiede im Krankheitsverlauf zu verstehen.
Die Wissenschaftler*innen verknüpfen, analysieren und interpretieren Daten, die mittels Genomik, Transkriptomik und Metabolomik generiert wurden, und nutzen dabei auch Proben und Daten, die im Rahmen des RESIST-Exzellenzclusters an der MH Hannover gesammelt wurden. Dank technologischer Fortschritte können Omics-Daten heute relativ schnell und kostengünstig gewonnen werden. Die Herausforderung besteht jedoch darin, diese riesigen Datenmengen zu analysieren und zu interpretieren. MoReHealth entwickelt standardisierte Verfahren zur Sammlung, Speicherung und Interpretation von MultiOmics-Daten. Dazu etabliert das Projekt eine sichere, modulare Datenbankplattform und entwickelt KI-gestützte Werkzeuge, mit denen sich komplexe Interaktionen entschlüsseln und besser verstehen lassen.
Genomik am Institut für Humangenetik der UMG
Genomische Daten spielen eine zentrale Rolle im MoReHealth-Projekt. Die Arbeitsgruppe um Prof. Bernd Wollnik, Direktor des Instituts für Humangenetik an der UMG, nutzt die Long-Read-Genomsequenzierung und entschlüsselt das komplette Erbgut von 100 Personen der RESIST-Kohorte. Mit diesem Verfahren lassen sich sehr lange DNA-Abschnitte über mehrere Gene hinweg bis hin zu ganzen Chromosomen ablesen. Zudem können damit Veränderungen in der Struktur des Erbguts und seltene DNA-Varianten aufgespürt werden, die herkömmliche Methoden nicht erkennen. So wollen die Wissenschaftler*innen genetische Varianten identifizieren, die das Risiko für Virusinfektionen erhöhen oder beeinflussen, wie der Körper darauf reagiert. Diese Erkenntnisse sind entscheidend für eine präzisere Diagnostik und eine individuell angepasste Therapie.
Ein weiterer wichtiger Baustein des Projekts ist die Bestimmung von Varianten in der mitochondrialen DNA (mtDNA) durch besondere Methoden der mtDNA-Sequenzierung. Mitochondrien, die „Kraftwerke“ der Zellen, besitzen ein eigenes kleines Genom. Mit dem Alter häufen sich in der mtDNA Veränderungen an, ein Vorgang der zunehmend mit einer Schwächung des Immunsystems und chronischen Entzündungen in Verbindung gebracht wird. Die Wissenschaftler*innen um Bernd Wollnik und Julia Schmidt wollen mtDNA-Mutationssignaturen identifizieren, die einen ungünstigen Krankheitsverlauf einer Virusinfektion bzw. chronische Komplikationen vorhersagen, und herausfinden, wie diese Mutationen die zelluläre Energieproduktion und das Immunsystem beeinträchtigen. In Kollaboration mit führenden Expert*innen an der Technischen Universität Braunschweig untersuchen sie mittels neuester Metabolomik-Technologien, welche metabolischen Störungen durch die mtDNA-Mutationen verursacht werden.
Eine strategische Investition in die Präzisionsmedizin
Die Bedeutung von MoReHealth geht jedoch über diesen konkreten Praxisfall hinaus: Das Projekt entwickelt erstmalig ein Modell, wie große molekulare Datenmengen in der Gesundheitsforschung effektiv genutzt werden und u.a. mittels KI-gestützter Analytik in klinische Entscheidungen einfließen können. Dazu soll eine skalierbare, mit der Europäischen Datenschutzgrundverordnung konforme MultiOmics-Datenplattform aufgebaut werden, die internationalen Qualitätsstandards entspricht und nahtlos über mehrere Forschungseinrichtungen hinweg integriert werden kann.
Für Professor Wollnik ist MoReHealth mehr als ein reines Forschungsprojekt: „MoreHealth ist eine strategische Investition in die Zukunft der personalisierten Gesundheitsversorgung in Niedersachsen. Mit diesem ersten Anwendungsfall – der altersbedingten Anfälligkeit für schwere Virusinfektionen – schaffen wir ein robustes, validiertes und transformatives Konzept. Es ermöglicht, MultiOmics-Daten in der Biomedizin zu nutzen, um Erkrankungen auf der Grundlage des individuellen molekularen Profils einer Person vorherzusagen, zu vermeiden und zu behandeln. Gleichzeitig setzt MoReHealth neue Maßstäbe für eine nachhaltige, kollaborative Forschungsinfrastruktur in Niedersachsen.“
Kontakt: Prof. Dr. med. Bernd Wollnik, Institut für Humangenetik, bernd.wollnik@med.uni-goettingen.de